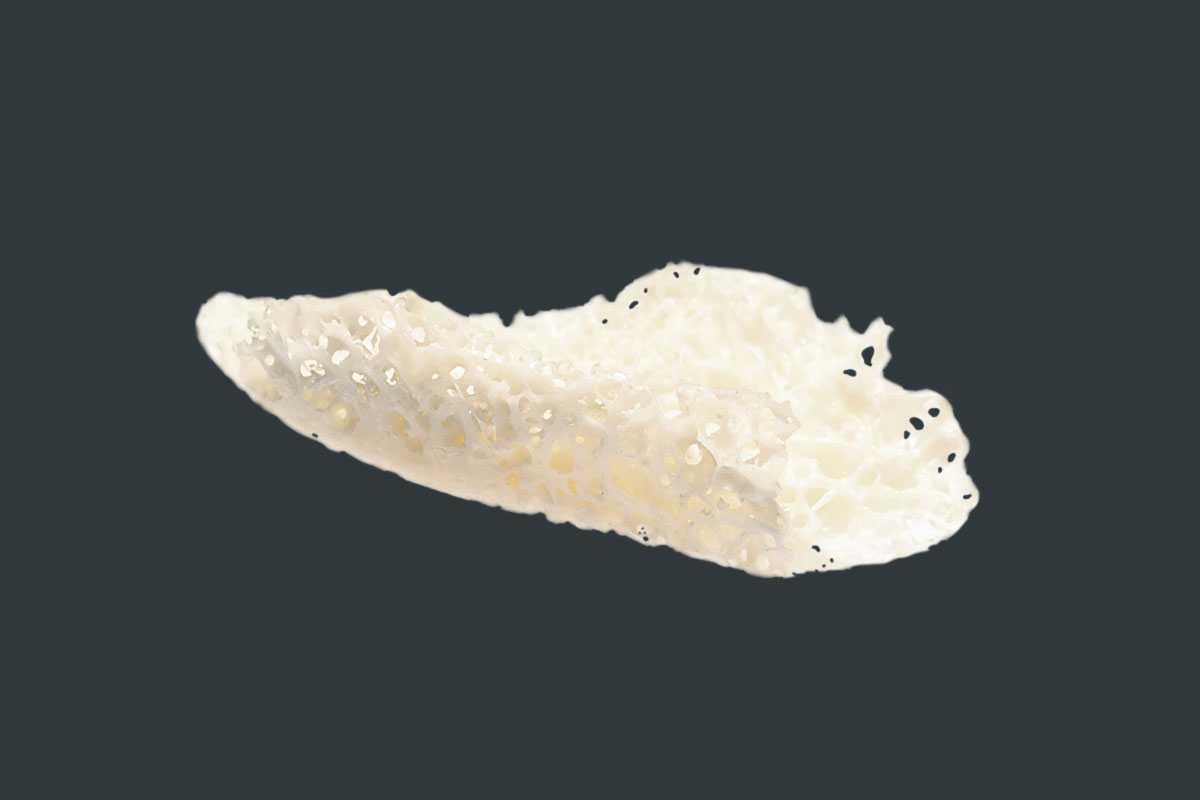
maxgraft ® bonebuilder
PATIENTENINDIVIDUELLER ALLOGENER KNOCHENBLOCK

hohe Präzision
CAD/CAM TechnOLOGIE
KÜRZERE BEHANDLUNGSZEITEN
maxgraft® bonebuilder ist ein individuell auf den Patientendefekt angepasster allogener Knochenblock aus humanem Spenderknochen, der von der Cells+Tissuebank Austria in einem speziellen Reinigungsverfahren (Allotec®-Verfahren) aufbereitet wird und in spongiöser Form erhältlich ist. Die dreidimensionale Passform wird mit modernster 3D-CAD/CAM-Technologie geplant und der Block kann mit hoher Präzision in kürzester Zeit eingesetzt werden. Die Operationszeit kann signifikant verkürzt und die Infektionsgefahr deutlich reduziert werden. Ein höherer Patientenkomfort ohne zusätzliche Schmerzen und ohne Entnahmestellenmorbidität ist das Resultat1,2.
Blockdesign mit CAD/CAM TechnOLOGIE
Durch die präoperative Planung der idealen Passform mit 3D-CAD/CAM-Technologie kann ein optimaler Kontakt des Blocks zum Empfängerbett erreicht werden. Die manuelle Anpassung des spongiösen Blocks ist in der Regel nicht mehr erforderlich. Die maxgraft® bonebuilder Planung erfolgt im interaktiven Austausch zwischen dem klinischen Anwender und den botiss CAD-Designern. Nähere Informationen zur individuellen Herstellung finden Sie auf der maxgraft® bonebuilder-Webseite.
HOHE PATIENTENAKZEPTANZ – KÜRZERE BEHANDLUNGSZEITEN
Aufgrund seiner hohen biologischen Regenerationsfähigkeit und dem vollständigen Umbau, stellt maxgraft® eine Alternative zum patienteneigenen Knochen dar. Die Notwendigkeit einer zweiten Operationsstelle entfällt, die Operationszeit wird verkürzt und die postoperativen Schmerzen sowie Morbidität für den Patienten werden deutlich verringert.
IMPLANTOLOGIE, ORAL- UND MUND-, KIEFER-, GESICHTSCHIRURGIE
- Horizontale und vertikale Augmentation
- Komplexe Knochendefekte
Datenqualität und Passung
Für die 3D-Planung sollten die CT/DVT-Daten so aktuell wie möglich sein um ein bestmögliches Ergebnis zu erreichen. Abhängig von der Bildgebung und möglicher Knochenveränderungen während des Herstellungsprozesses lassen sich geringe Abweichungen in der Passgenauigkeit nicht zur Gänze ausschließen. Die Vorbereitung geeigneter Instrumente zur manuellen Nachbearbeitung des Blocks wird empfohlen.
Rehydrierung
Der Produktionsprozess von maxgraft® erhält das natürliche Kollagen und eine Restfeuchte von <10%. Dennoch wird eine Rehydrierung empfohlen (10 Minuten in physiologischer Kochsalzlösung), um die Anpassungsfähigkeit des Materials an den Defekt, insbesondere bei großen Blöcken, zu verbessern3. maxgraft® bonebuilder kann auch in einer Einwegspritze unter Vakuum in physiologischer Kochsalzlösung (Technik nach Dr. Blume) kurz rehydriert werden.
Fixierung – Zugschraubentechnik
maxgraft® bonebuilder muss stabilisiert werden, um jegliche Mikro-Bewegung zu vermeiden und so eine gute Einheilung zu gewährleisten. Der direkte Kontakt zwischen ortsständigem Knochen und maxgraft® bonebuilder sorgt für eine sichere Inkorporation und schnelle Regeneration. Bei der Zugschraubentechnik wird in den Knochenblock ein Gleitloch gebohrt (Bohrer-Durchmesser entspricht Schraubendurchmesser), während für den ortsständigen Knochen ein Bohrer mit minimal kleinerem Durchmesser verwendet wird. Vor dem Fixieren sollte ein passender Kopfraum für die Schrauben z. B. mit einer diamantbeschichteten Kugelfräse geschaffen werden, um Weichgewebeirritationen durch überstehende Schraubenköpfe zu vermeiden. Flachköpfige Osteosyntheseschrauben werden empfohlen, um scharfe Kanten zu vermeiden.
Kombination mit cerabone® oder maxgraft® Partikeln
An den Rändern des maxgraft® bonebuilder kann partikuläres Knochenersatzmaterial (z.B. cerabone® oder maxgraft® Granulat) zur Konturierung eingesetzt werden. Volumenstabile Knochenersatzmaterialien wie cerabone® können auch als Resorptionsschutz z.B. insbesondere in der ästhetischen Zone eingesetzt werden.
Guided Bone Regeneration – Verwendung einer Barrieremembran
maxgraft® bonebuilder sollte mit einer Membran mit ausreichend langer Barrierefunktion (z.B. Jason® membrane) abgedeckt werden, um eine gesteuerte Knochenregeneration zu erzielen und das Einwachsen von Weichgewebe zu verhindern.
Wundverschluss
Die Abwägung der Weichgewebssituation vor dem Eingriff ist notwendig. Die Wunde muss spannungsfrei verschlossen werden. Eine überlappende Mobilisierung des Weichgewebes vor dem Nähen sollte möglich sein.
Reentry
Die Einheilzeit für maxgraft® bonebuilder beträgt in der Regel ca. sechs Monate (je nach Lage, Geometrie und Ausmaß des Defekts). Beim Wiedereröffnen werden die Osteosyntheseschrauben entfernt.
- Natürliches, mineralisiertes Kollagen
- Erhaltene trabekuläre, spongiöse Struktur menschlichen Knochens
- Osteokonduktive Eigenschaften, die ein natürliches und kontrolliertes Remodelling unterstützen
- Max. Größe 23 x 13 x 13 mm (bei größeren Defekten können mehrere Blöcke pro Patient designt werden)

Produktspezifikationen
maxgraft® bonebuilder
| Art.-Nr. | Inhalt |
|---|---|
| PMIa | Individuelle Planung und Produktion eines Knochenblocks, max. Maße 23 x 13 x 13 mm |
| PMIa 2 | maxgraft® bonebuilder, jeder weitere für diesen Patienten |
bonebuilder dummy
| Art.-Nr. | Inhalt |
|---|---|
| 32100 | Individuelles 3D-gedrucktes Plastikmodell des Patientendefekts und des geplanten maxgraft® bonebuilders zu Demonstrationszwecken |
Vertrieb
Mit unserem internationalen Netzwerk von Vertriebspartnern stehen wir Ihnen weltweit in über 100 Ländern zur Verfügung. Neben unserem 360°-Produktportfolio bieten wir Ihnen Service, wissenschaftliche Beratung und Austausch, Fortbildungen und Kongresse direkt vor Ort aus einer Hand.
Finden Sie einen Vertriebspartner in Ihrer Nähe.
SPEZIFISCHE FAKTEN
CASES
PUBLIKATIONEN
FORTBILDUNG
- Dr. Michael BackGermanyDr. Oliver BlumeGermany
EDUTAINMENT
- Dr. Hassan MaghairehUnited Kingdom
HANDLING
Verwandte Produkte

Jason® membrane
Native Perikardiummembran für die GBR/GTR
Eine aus Schweineperikard gewonnene native Kollagenmembran, die multidirektionale Zug- und Reißfestigkeit bietet.

maxgraft® blocks
PROZESSIERTES HUMANES ALLOGRAFT
Allogene Knochenersatzmaterialien aus humanem Spenderknochen, welche von der Cells+Tissuebank Austria im Allotec®-Verfahren aufbereitet werden und in spongiöser und kortiko-spongiöser Form erhältlich sind.

cerabone®
100% REINES KNOCHENMINERAL
Ein 100% reines Knochenmineral bovinen Ursprungs, das mittels eines einzigartigen 1200°C-Herstellungsprozesses gewonnen wird.