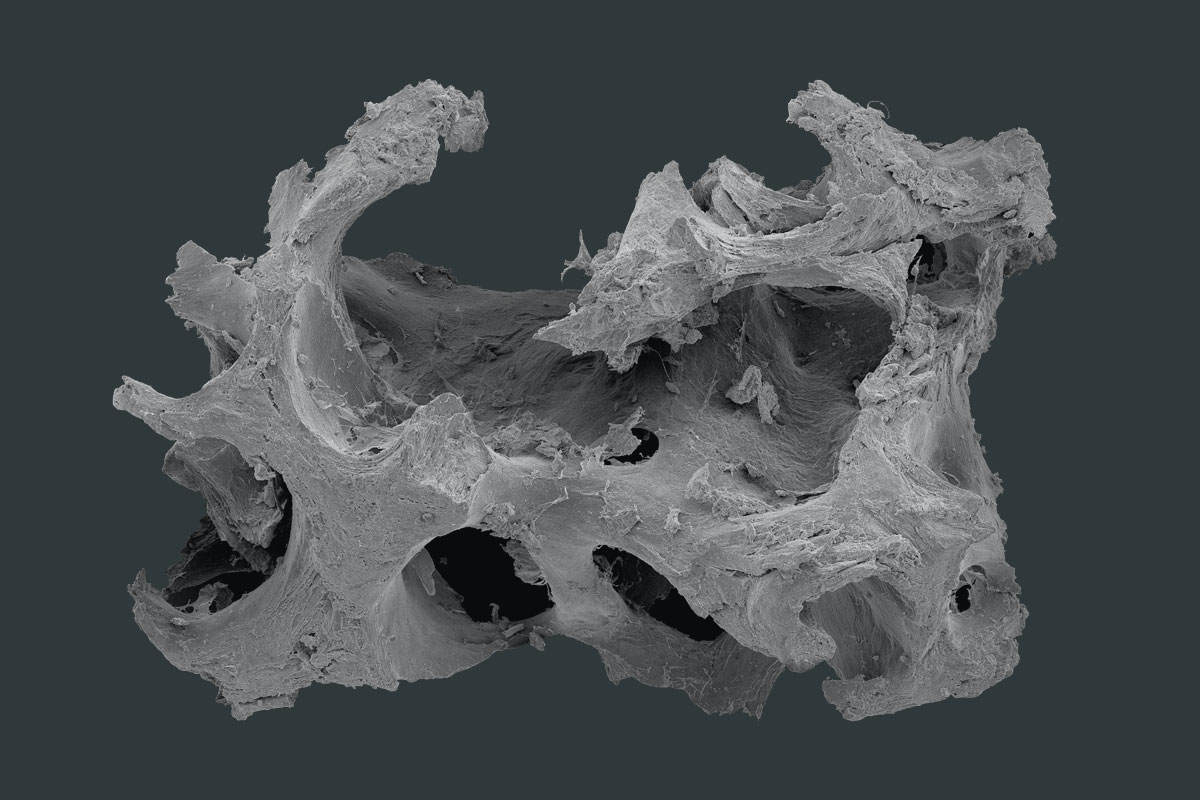
maxgraft® granules
PROZESSIERTES HUMANES ALLOGRAFT

natürliche Knochenregeneration
KÜRZERE BEHANDLUNGSZEITEN
früherer Reentry
maxgraft® ist ein allogenes Knochenersatzmaterial aus humanem Spenderknochen, das von der Cells+Tissuebank Austria in einem speziellen Reinigungsverfahren (Allotec®-Verfahren) aufbereitet wird und in spongiöser und kortiko-spongiöser Form erhältlich ist. Aufgrund der erhaltenen Knochenstruktur und des Kollagenanteils des menschlichen Knochens dienen maxgraft® Granula als Gerüst für die natürliche Knochenregeneration und haben das Potenzial, vollständig in patienteneigenen Knochen umgebaut zu werden 1,2.
SCHNELLE REGENERATION
Die spongiöse Struktur ermöglicht eine optimale Revaskularisierung und Versorgung mit vitalen Zellen und somit eine schnelle Regeneration von vitalem Knochengewebe1. Durch die Zugabe eines kompakten und dichten Knochenanteils zu den spongiösen Granula (maxgraft® kortiko-spongiöse Granula) ist eine größere Volumenstabilität gegeben, was z.B. bei Augmentationen außerhalb der Kieferkammkontur von Vorteil ist. Abhängig von der Defektgröße werden maxgraft® Granula innerhalb von 3–4 Monaten stabil ein- und teils umgebaut und ermöglichen somit einen früheren Reentry im Vergleich zu anderen Knochenersatzmaterialien2.
HOHE PATIENTENAKZEPTANZ – KÜRZERE BEHANDLUNGSZEITEN
Aufgrund seiner hohen biologischen Regenerationsfähigkeit und dem vollständigen Umbau, stellt maxgraft® eine Alternative zum patienteneigenen Knochen dar. Die Notwendigkeit einer zweiten Operationsstelle entfällt, die Operationszeit wird verkürzt und die postoperativen Schmerzen sowie Morbidität für den Patienten werden deutlich verringert.
- Regeneration von Extraktionsalveolen (Socket Preservation)
- Regeneration von fehlendem Knochengewebe um Zahnimplantate
- Sinusaugmentation
- Regeneration parodontaler Knochendefekte
- Dreidimensionale (horizontale und/oder vertikale) Kieferkammaugmentation
- Knöcherne Defekte
Rehydrierung
Der Produktionsprozess von maxgraft® erhält das natürliche Kollagen und eine Restfeuchte von <10%. Eine Rehydrierung ist nicht zwingend notwendig. Jedoch kann die Rehydrierung mit Blut oder Kochsalzlösung das Handling und das Einbringen durch das Zusammenkleben von maxgraft® Granula erleichtern.
Anwendung
Das Komprimieren der Partikel sollte vermieden werden. Weniger dicht gepackte Partikel bieten mehr Raum für das Einwachsen von Blutgefäßen und Knochenneubildung.
Mischen mit autologem Knochen
Das Mischen von maxgraft® Granula mit autologem Knochen steigert die biologische Aktivität in der Defektstelle und trägt zu einer noch schnelleren Regeneration und Knochenneubildung bei.
Kombination mit cerabone®
Durch Mischen der maxgraft® Granula mit cerabone® werden die Vorteile beider Materialien kombiniert. Das biologische Potenzial der maxgraft® Granula und die langzeitige Volumenstabilität von cerabone® führen zu einer schnellen Regeneration starken vitalen Knochens.
Guided Bone Regeneration – Verwendung einer Barrieremembran
maxgraft® Granula sollten im Sinne der gesteuerten Knochenregeneration mit einer Barrieremembran (z.B. Jason® membrane, collprotect® membrane) abgedeckt werden, dies verhindert eine vorzeitige Resorption und das Einwachsen von Weichgewebe.
Wundverschluss
Die Abwägung der Weichgewebssituation vor dem Eingriff ist notwendig. Die Wunde muss spannungsfrei verschlossen werden. Eine überlappende Mobilisierung des Weichgewebes vor dem Nähen sollte möglich sein.
Reentry
Je nach Defektmorphologie beträgt die Einheilzeit von maxgraft® Granula 3-4 Monate (z.B. Socket Preservation, kleinere Knochendefekte, parodontale Defekte). Im Anschluss an die Einheilung sollte zeitnah der Reentry mit Implantatsetzung erfolgen, um eine Degradation zu verhindern.
- Natürliches mineralisiertes Kollagen
- Dreidimensionales Poren-Netzwerk und raue Oberfläche
- Osteokonduktive Leitschiene, die ein natürliches und kontrolliertes Remodelling unterstützt3,4
Produktspezifikationen

maxgraft® spongiöse Granula
| Art.-Nr. | Partikelgröße | Inhalt |
|---|---|---|
| 30005 | < 2,0 mm | 1 × 0,5 ml |
| 30010 | < 2,0 mm | 1 × 1,0 ml |
| 30020 | < 2,0 mm | 1 × 2,0 ml |
| 30040 | < 2,0 mm | 1 × 4,0 ml |
| 30005S | 0,25–1mm | 1 × 0,5 ml |
| 30010S | 0,25–1mm | 1 × 1,0 ml |
| 30020S | 0,25–1mm | 1 × 2,0 ml |
| 30040S | 0,25–1mm | 1 × 4,0 ml |
| 30005L | 1,0–2,0 mm | 1 × 0,5 ml |
| 30010L | 1,0–2,0 mm | 1 × 1,0 ml |
| 30020L | 1,0–2,0 mm | 1 × 2,0 ml |
| 30040L | 1,0–2,0 mm | 1 × 4,0 ml |
maxgraft® kortiko-spongiöse Granula
| Art.-Nr. | Partikelgröße | Inhalt |
|---|---|---|
| 31005 | < 2,0 mm | 1 × 0,5 ml |
| 31010 | < 2,0 mm | 1 × 1,0 ml |
| 31020 | < 2,0 mm | 1 × 2,0 ml |
| 31040 | < 2,0 mm | 1 × 4,0 ml |
| 31005S | 0,25–1mm | 1 × 0,5 ml |
| 31010S | 0,25–1mm | 1 × 1,0 ml |
| 31020S | 0,25–1mm | 1 × 2,0 ml |
| 31040S | 0,25–1mm | 1 × 4,0 ml |
| 31005L | 1,0–2,0 mm | 1 × 0,5 ml |
| 31010L | 1,0–2,0 mm | 1 × 1,0 ml |
| 31020L | 1,0–2,0 mm | 1 × 2,0 ml |
| 31040L | 1,0–2,0 mm | 1 × 4,0 ml |
Vertrieb
Mit unserem internationalen Netzwerk von Vertriebspartnern stehen wir Ihnen weltweit in über 100 Ländern zur Verfügung. Neben unserem 360°-Produktportfolio bieten wir Ihnen Service, wissenschaftliche Beratung und Austausch, Fortbildungen und Kongresse direkt vor Ort aus einer Hand.
Finden Sie einen Vertriebspartner in Ihrer Nähe.
SPEZIFISCHE FAKTEN
CASES
PUBLIKATIONEN
FORTBILDUNG
- Dr. Jochen TunkelGermany
EDUTAINMENT
HANDLING
- botiss biomaterialsGermany
Verwandte Produkte

maxgraft® cortico
ALLOGENE KNOCHENPLÄTTCHEN FÜR DIE SCHALENTECHNIK
Ein allogenes Knochenersatzmaterial aus humanem Spenderknochen

maxgraft® blocks
PROZESSIERTES HUMANES ALLOGRAFT
Allogene Knochenersatzmaterialien aus humanem Spenderknochen, welche von der Cells+Tissuebank Austria im Allotec®-Verfahren aufbereitet werden und in spongiöser und kortiko-spongiöser Form erhältlich sind.
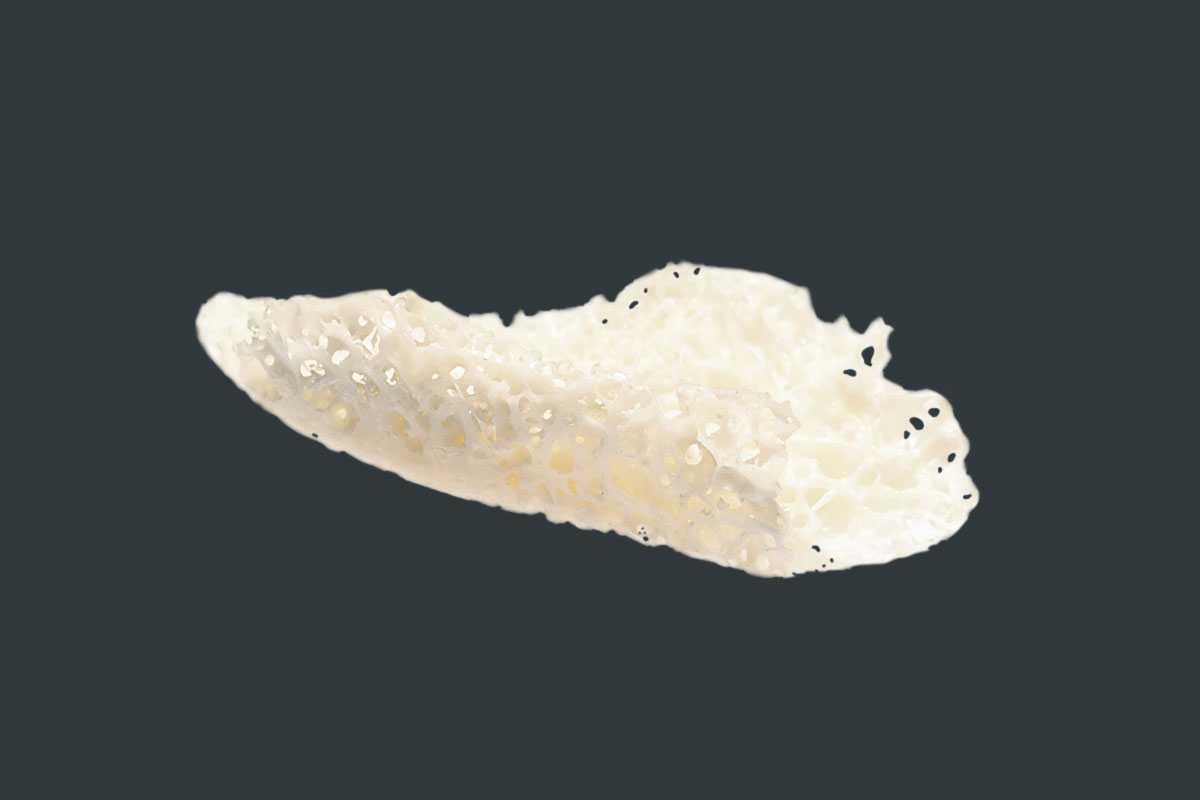
maxgraft® bonebuilder
PATIENTENINDIVIDUELLER ALLOGENER KNOCHENBLOCK
maxgraft® bonebuilder ist ein individuell auf den Patientendefekt angepasster allogener Knochenblock aus humanem Spenderknochen